La neuropatía periférica (NP) es un conjunto de síntomas causados por el daño a los nervios que se encuentran fuera del cerebro y la médula espinal (nervios periféricos). Estos nervios conducen al cerebro las sensaciones, como hormigueo, dolor y calambres, entre otros, en diferentes partes del cuerpo. Controlan el movimiento de los brazos y las piernas, así como la vejiga y los intestinos. Esta patología afecta entre el 2% y 7% de la población mundial y su frecuencia aumenta con la edad, con una prevalencia del 13,5% en estadounidenses mayores de 40 años.
Síntomas y causas de la neuropatía periférica
Los pacientes afectados de neuropatía periférica pueden presentar síntomas sensoriales, motores o ambos, lo que conduce a un aumento de las tasas de mortalidad. Esta patología tiene una amplia variedad de causas, incluidas las congénitas, como la enfermedad de Charcot-Marie-Tooth (CMT), la enfermedad crónica polineuropatía desmielinizante inflamatoria (CIDP), inflamatoria y trastornos autoinmunes, neuropatía motora multifocal (MMN), lesiones por atrapamiento, síndromes metabólicos como la diabetes mellitus y síndromes paraneoplásicos. A pesar de esta amplia variedad de causas, las características clínicas y de imagen que las distinguen pueden ayudar a diagnosticarla, así como calificar su gravedad para respaldar las decisiones de tratamiento.
Diagnóstico de la neuropatía periférica
Los principales métodos para el diagnóstico objetivo de la neuropatía periférica incluyen pruebas de neurodiagnóstico (electromiografía y conducción nerviosa), ecografía y neurografía por resonancia magnética.
- Pruebas de neurodiagnóstico
Las pruebas de neurodiagnóstico se han considerado tradicionalmente el estándar de referencia. Sin embargo, en algunos casos, su uso es limitado para definir una causa específica (estructural vs. no estructural) o en la caracterización de una lesión por alteración anatómica.
- Ecografía
La ecografía permite el diagnóstico superficial de la neuropatía periférica, ya que su precisión diagnóstica depende de la experiencia del ecografista, lo que limita su objetividad. La mayor ventaja de la ecografía, respecto a técnicas más complejas, reside en su habilidad de realizar un estudio en vivo y observar las relaciones dinámicas de los nervios con las estructuras que los rodean.
- Neurografía por resonancia magnética
La neurografía por resonancia magnética es una técnica objetiva para la evaluación de la neuropatía periférica, ya que contribuye a la toma de decisiones preoperatorias ayudando al manejo clínico y diagnóstico. Esta técnica muestra la ubicación de la neuropatía periférica, permite la visualización anatómica y caracterización de lesiones focales de condiciones difusas con excelente contraste de tejidos blandos, incluso para anatomías más profundas como plexos y otras estructuras. Además, muestra posibles causas subyacentes, como una masa o un músculo anómalo. Según un estudio realizado a pacientes con lesiones de los nervios de las extremidades superiores, la resonancia magnética tuvo un impacto moderado a importante en la gestión del 84% de los casos de neuropatía periférica.
Procedimiento de la neurografía por resonancia magnética
El protocolo para la realización del estudio de neurografía mediante resonancia magnética no es convencional. Equipos de Resonancia Magnética de 3 Teslas permiten obtener secuencias diseñadas específicamente para la visualización de las estructuras de los nervios periféricos. El tiempo de la prueba es de 30 minutos, en los estudios más simples, y de hasta 45 minutos, en los más complejos o con maniobras de provocación.
La prueba se realiza con administración de contraste, que, tal y como han demostrado numerosos estudios, supone una ventaja a la hora de identificar las estructuras vasculares y las lesiones de la barrera hematoneural, donde discurren los vasos nutrición del nervio y se encuentran las células de soporte de este.
Para la realización de la prueba se requiere de la supervisión in situ por parte de un profesional médico con experiencia. Este podrá decidir si ve oportuno completar el estudio con una ecografía.
En CreuBlanca, llevamos en nuestro ADN la innovación. Por ello, apostamos por las más avanzadas técnicas de diagnóstico por la imagen para la detección de múltiples patologías. Prueba de ello es la neurografía por resonancia magnética, que ha demostrado ser una técnica de vanguardia para la detección de la neuropatía periférica.
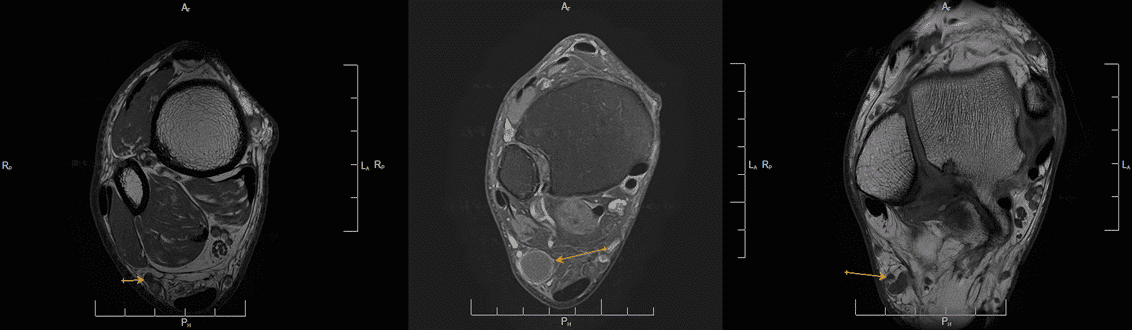
Imágenes de la neurografía por resonancia magnética
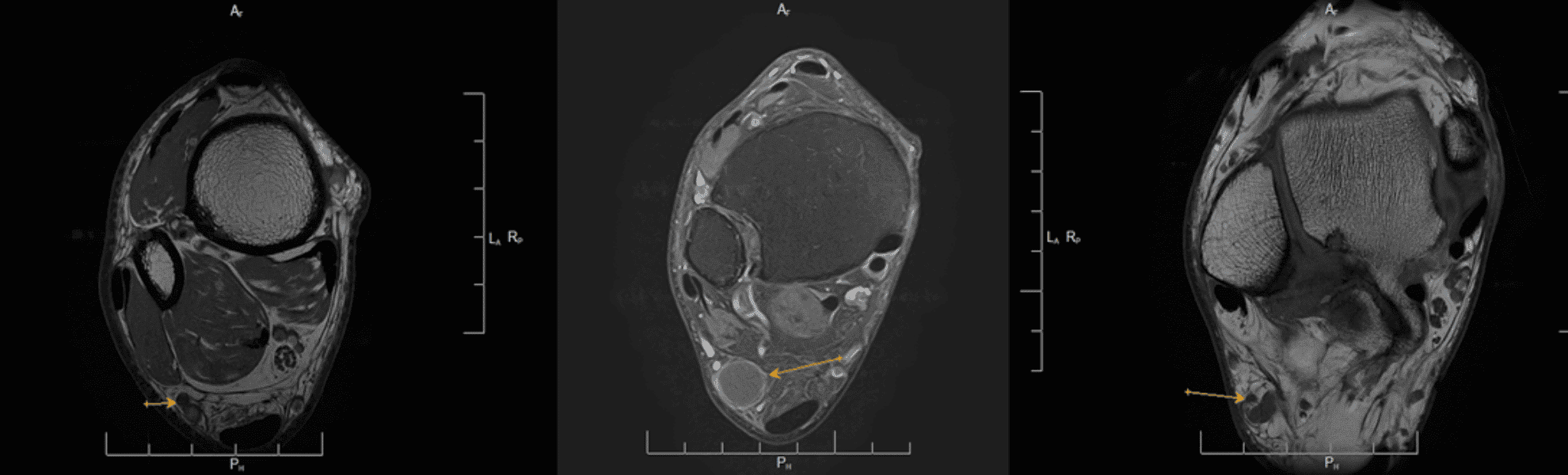
Neuropatía Nervio supraescapular con denervación pertinente de sus grupos musculares, con compresión a nivel plexual. (Personage Turner)
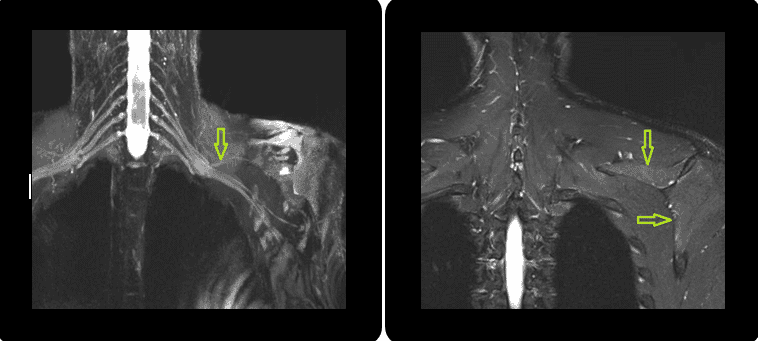
Neuropatía del Nervio interóseo posterior (NIP) en Arcada de Froshe con una doble compresión en tándem en el margen proximal y distal.
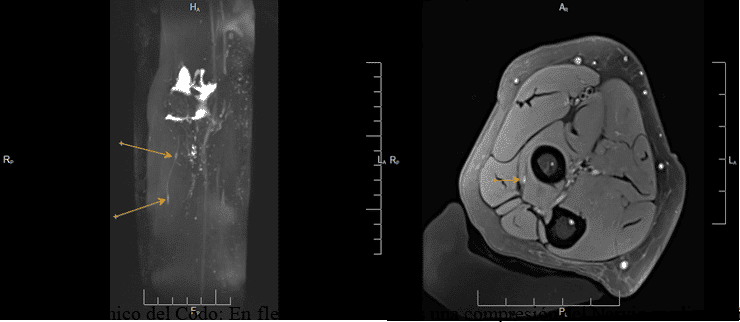
Estudio Dinámico del Codo: En flexión demostramos una compresión del Nervio mediano Síndrome del Pronador Teres. En posición anatómica no se identificaba dicha compresión.
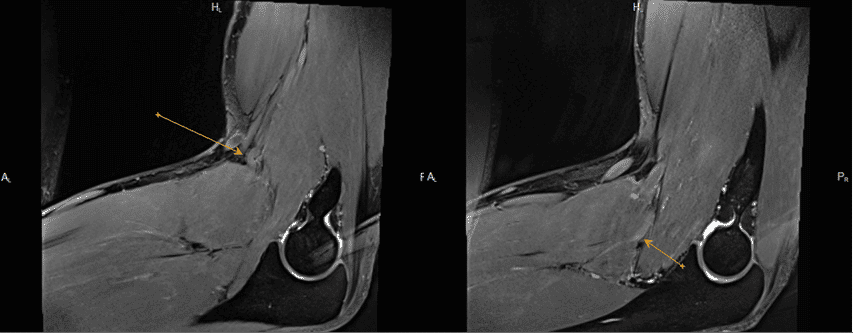
Sospecha de neuroma del nervio safeno, estudio demuestra la existencia de un ganglión de las vainas de los tendones peroneos que comprime y desplaza el nervio safeno.
Bibliografía:
- Callaghan BC, Kerber KA, Lisabeth LL, et al. Role of neurologists and diagnostic tests on the management of distal symmetric polyneuropathy.
JAMA Neurol 2014; 71:1143–1149 - Hicks CW, Wang D, Matsushita K, Windham BG, Selvin E. Peripheral neuropathy and all-cause and cardiovascular mortality in U.S. adults: a prospective cohort study. Ann Intern Med 2021; 174:167–174
- Lau KHV. Laboratory evaluation of peripheral neuropathy. Semin Neurol
2019; 39:531–541 - Martyn CN, Hughes RA. Epidemiology of peripheral neuropathy. J Neurol
Neurosurg Psychiatry 1997; 62:310–318 - Hanewinckel R, Ikram MA, Van Doorn PA. Peripheral neuropathies. Handb
Clin Neurol 2016; 138:263–282 - Buxton WG, Dominick JE. Electromyography and nerve conduction stud-
ies of the lower extremity: uses and limitations. Clin Podiatr Med Surg 2006;
23:531–543 - Daniels SP, Ross AB, Sneag DB, Gardon SN, Li G, Hanna A, Tuite MJ. Intravenous contrast does not improve detection of nerve lesions or active muscle denervation changes in MR neurography of the common peroneal nerve. Skeletal Radiol. 2021 Dec;50(12):2483-2494. doi: 10.1007/s00256-021-03812-w. Epub 2021 May 22. PMID: 34021773.
- Sneag DB, Daniels SP, Geannette C, Queler SC, Lin BQ, de Silva C, Tan ET. Post-Contrast 3D Inversion Recovery Magnetic Resonance Neurography for Evaluation of Branch Nerves of the Brachial Plexus. Eur J Radiol. 2020 Nov;132:109304. doi: 10.1016/j.ejrad.2020.109304. Epub 2020 Sep 28. PMID: 33035919.
- Kwee RM, Chhabra A, Wang KC, Marker DR, Carrino JA. Accuracy of MRI in
diagnosing peripheral nerve disease: a systematic review of the literature.
AJR 2014; 203:1303–1309 - Chhabra A, Belzberg AJ, Rosson GD, et al. Impact of high resolution 3 Tesla
MR neurography (MRN) on diagnostic thinking and therapeutic patient
management. Eur Radiol 2016; 26:1235–1244 - Andreisek G, Burg D, Studer A, Weishaupt D. Upper extremity peripheral neuropathies: role and impact of MR imaging on patient management. Eur
Radiol 2008; 18:1953–1961 - Thakkar RS, Del Grande F, Thawait GK, Andreisek G, Carrino JA, Chhabra A. Spectrum of high-resolution MRI findings in diabetic neuropathy. AJR
2012; 199:407–412 - Hardy PA. Editorial for “Microstructural integrity of peripheral nerves in Charcot-Marie-Tooth (CMT) disease: an MRI evaluation study.” J Magn
Reson Imaging 2021; 53:445–446 - Shah S, Morrow JM, Sinclair CDJ, et al. MRI quantifies lumbosacral nerve root and sciatic nerve hypertrophy in chronic inflammatory demyelinating
polyradiculoneuropathy. Eur J Radiol 2020; 130:109164 - Chhabra A, Chalian M, Soldatos T, et al. 3-T high-resolution MR neurogra-
phy of sciatic neuropathy. AJR 2012; 198:[web]W357–W364 - Daniels SP, Ross AB, Sneag DB, et al. Intravenous contrast does not improve
detection of nerve lesions or active muscle denervation changes in MR
neurography of the common peroneal nerve. Skeletal Radiol 2021;
50:2483–2494 - Sneag DB, Zochowski KC, Tan ET. MR neurography of peripheral nerve inju-
ry in the presence of orthopedic hardware: technical considerations. Ra-
diology 2021; 300:246–259 - Kumar Y, Wadhwa V, Phillips L, Pezeshk P, Chhabra A. MR imaging of skele-
tal muscle signal alterations: systematic approach to evaluation. Eur J Radi-
ol 2016; 85:922–935 - Chhabra A, Ahlawat S, Belzberg A, Andreseik G. Peripheral nerve injury
grading simplified on MR neurography: as referenced to Seddon and Sun-
derland classifications. Indian J Radiol Imaging 2014; 24:217–224Downloaded from www.ajronline.org by SERAM on 08/20/22 from IP address 5.9.7.212.
286 AJR:219, August 2022 - Zuniga JR, Mistry C, Tikhonov I, Dessouky R, Chhabra A. Magnetic reso-
nance neurography of traumatic and nontraumatic peripheral trigeminal
neuropathies. J Oral Maxillofac Surg 2018; 76:725–736 - Ahlawat S, Belzberg AJ, Fayad LM. Utility of magnetic resonance imaging
for predicting severity of sciatic nerve injury. J Comput Assist Tomogr 2018;
42:580–587 - Ahlawat S, Chhabra A, Blakely J. Magnetic resonance neurography of pe-
ripheral nerve tumors and tumorlike conditions. Neuroimaging Clin N Am
2014; 24:171–192 - Wilson TJ, Howe BM, Stewart SA, Spinner RJ, Amrami KK. Clinicoradiologi-
cal features of intraneural perineuriomas obviate the need for tissue diag-
nosis. J Neurosurg 2018; 129:1034–1040 - Luna R, Fayad LM, Rodriguez FJ, Ahlawat S. Imaging of non-neurogenic pe-
ripheral nerve malignancy: a case series and systematic review. Skeletal
Radiol 2021; 50:201–215 - Demehri S, Belzberg A, Blakeley J, Fayad LM. Conventional and functional
MR imaging of peripheral nerve sheath tumors: initial experience. AJNR
2014; 35:1615–1620 - Chhabra A, Soldatos T, Durand DJ, Carrino JA, McCarthy EF, Belzberg AJ. The
role of magnetic resonance imaging in the diagnostic evaluation of malig-
nant peripheral nerve sheath tumors. Indian J Cancer 2011; 48:328–334 - Subhawong TK, Wang KC, Thawait SK, et al. High resolution imaging of
tunnels by magnetic resonance neurography. Skeletal Radiol 2012; 41:15–31 - Krishnan KR, Wolfe SW, Feinberg JH, Nwawka OK, Sneag DB. Imaging and
treatment of phrenic nerve hourglass-like constrictions in neuralgic amy-
otrophy. Muscle Nerve 2020; 62:E81–E82 - Sneag DB, Arányi Z, Zusstone EM, et al. Fascicular constrictions above el-
bow typify anterior interosseous nerve syndrome. Muscle Nerve 2020;
61:301–310 - van Rosmalen MHJ, Goedee HS, Derks R, et al. Quantitative magnetic reso-
nance imaging of the brachial plexus shows specific changes in nerve ar-
chitecture in chronic inflammatory demyelinating polyneuropathy, multi-
focal motor neuropathy and motor neuron disease. Eur J Neurol 2021;
28:2716–2726 - Chhabra A, Carrino JA, Farahani SJ, et al. Whole-body MR neurography:
prospective feasibility study in polyneuropathy and Charcot-Marie-Tooth
disease. J Magn Reson Imaging 2016; 44:1513–1521 - Thawait SK, Chaudhry V, Thawait GK, et al. High-resolution MR neurogra-
phy of diffuse peripheral nerve lesions. AJNR 2011; 32:1365–1372 - Sivakumaran T, Sneag DB, Lin B, Endo Y. MRI of the ulnar nerve pre- and
post-transposition: imaging features and rater agreement. Skeletal Radiol
2021; 50:559–570 - Chhabra A, Subhawong TK, Williams EH, et al. High-resolution MR neurog-
raphy: evaluation before repeat tarsal tunnel surgery. AJR 2011; 197:175–183 - Ng AWH, Griffith JF, Tsai CSC, Tse WL, Mak M, Ho PC. MRI of the carpal tun-
nel 3 and 12 months after endoscopic carpal tunnel release. AJR 2021;
216:464–470 - Chhabra A, Wadhwa V, Thakkar RS, Carrino JA, Dellon AL. Recurrent ulnar
nerve entrapment at the elbow: correlation of surgical findings and 3-Tesla
magnetic resonance neurography. Can J Plast Surg 2013; 21:186–189 - Stoyan D, Pommerening A, Hummel M, Kopp-Schneider A. Multiple-rater
kappas for binary data: models and interpretation. Biom J 2018; 60:381–394